Com o desenvolvimento da Química cresceu a necessidade de medirmos quantidades de matéria e de estabelecermos um padrão para suas grandezas. Os cientistas quantificaram e definiram entidades existentes na matéria a fim de descrever do que o Universo era feito, construindo um imenso emaranhado de átomos e moléculas.
Como estes minúsculos constituintes da matéria, átomo e moléculas, não são visíveis, uma pequena quantidade de qualquer substância possui um número muito grande deles. Neste caso o conceito de mol tornou-se bastante útil.
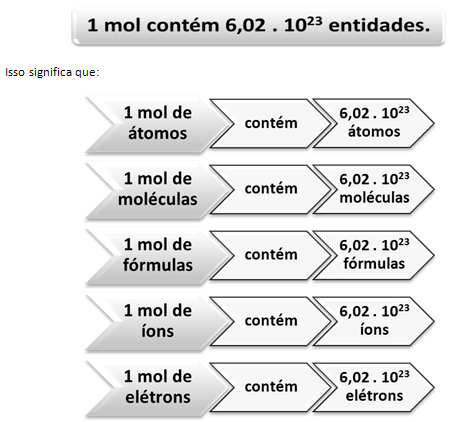 |
Figura 1: As entidades. Fonte: Alunos online
|
No início do século passado os cientistas já haviam adquirido uma razoável quantidade de informações sobre as reações químicas observadas entre os gases. Porém, o físico italiano Amedeo Avogadro (1776-1856), baseando-se em tais informações e em resultados de experiências realizadas por ele próprio, formulou no ano de 1811 uma hipótese extremamente importante, relacionando o número de moléculas existentes em duas amostras gasosas. Segundo Avogadro, se tomarmos dois recipientes de mesmo volume, contendo gases diferentes, ambos à mesma temperatura e pressão, o número de moléculas contidas em tal recipiente deverá ser o mesmo. Tomando por base o isótopo do carbono 12 (por ser um dos isótopos de carbono mais abundantes), ficou definido que 1 mol de carbono 12 contém 12 gramas de carbono. Contudo só anos mais tarde, com o aperfeiçoamento das técnicas de medição e novos experimentos é que foi possível estimar com precisão quanto vale o número de Avogadro (NA), ficando definido que em 1 mol existem 6,02 x 10²³ elementos.
1 mol = 6,02 x 10²³ = 12 gramas
 |
Figura 2: Número Avogadro. Fonte A graça da química
|
Na verdade não foi Avogadro quem chegou ao número, ele propôs que todas as substâncias deveriam ter a mesma quantidade de moléculas a uma determinada massa. Essa hipótese só foi comprovada pela experimentação científica realizada pelo físico-químico francês Jean-Baptiste Perrin (1870-1942), no início do século XX, realizou uma série de experiências, procurando determinar o valor de NA, concluindo que este valor estaria compreendido entre 6,5. 10²³ e 7,2. 10²³ moléculas em cada mol. Valor este que foi determinado com maior precisão. Com a definição do mol, surgiu a possibilidade de se chegar a esse número. Como 1 mol de Carbono12 tem 12g, e eles sabiam que a massa de um átomo de carbono vale: (1,99265x10-23g), os cientistas pegaram e dividiram 12g pela massa de um átomo de Carbono, chegando ao número 6x10²³ que seria o número de moléculas de uma substância.
12 / 1,99265x10²³ = 6,02 x10²³
O mol é considerado a ponte entre o mundo microscópico e o macroscópico. Por exemplo:
Imaginando a quantidade de um mol de bolinhas de ping pong com 4 cm de diâmetro cada uma. Qual o seria tamanho do recipiente necessário para armazenar essa quantidade de bolinhas de ping pong?
 |
| Figura 3: Bola inserida em caixa cúbica com 4 cm de aresta. Fonte: http://luckytoilet.wordpress.com/ |
1 bolinha (4cm diâmetro) --------------- 64 cm³ (volume recipiente)
6,023 . 10²³ bolinhas ---------------------- X cm³
X = 385,47. 10²³ cm³
Então para armazenarmos 1 mol de bolinhas de ping pong necessitaríamos de uma caixa medindo dois mil quilômetro de largura por dois mil quilômetros, o que corresponde a uma área de 4.000.000 km², suficiente para cobrir metade do território brasileiro e a caixa teria 10.000 km de altura. Isso á mais alto que a orbita da maioria dos satélites que transitam ao redor do nosso planeta:
 |
Figura 4: Proporção caixa / planeta. Fonte: autor
|
Utilizando outro exemplo agora pensando em gramas, quantos mols existem em 25 gramas de água?
1mol de H2O --------------- 18,015g
X mol de H2O -------------- 25g H2O
X= 1,39 mols de H2O, então em 25g de água existem 1,39 mols de moléculas de água.
REFERÊNCIAS
Moore, John T.. Química para Leigos. 1ª Edição, Rio de Janeiro, Editora Alta Books, 2011.
Acesso em 2014:
http://www.agracadaquimica.com.br/imagens/artigos/AVOGADRO.jp
http://www.alunosonline.com.br/upload/conteudo/images/constante-de-avogadro.jpg
http://cienciaehumanidade.blogspot.com.br/2010/05/lei-de-avogadro-e-o-numero-de-avogadro.html
http://historiadafisicauc.blogspot.com.br/2011/06/as-experiencias-de-perrin.html

1 Comentários
C7H14
ResponderExcluir